Дексаметазон в профилактики рвоты
Новости онкологии
05.09.2014
Дексаметазон эффективно предотвращает развитие тошноты и рвоты у больных раком молочной железы, получавших химиотерапию доксорубицином и циклофосфамидом
Тюляндин Сергей Алексеевич
Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
Тошнота и рвота, обусловленная химиотерапией, относится к числу наиболее тяжело переносимых осложнений для больного. К высокоэметогенным режимам относятся комбинации на основе цисплатина и доксорубицина (АС или FAC), которые широко используются при проведении адъювантной терапии у больных раком молочной железы. Для профилактики острой тошноты и рвоты (в первые 24 часа после введения препаратов) рекомендуется использовать комбинацию антагонистов рецепторов серотонина (например, ондансетрон) и нейрокинина-1 (апрепитант) совместно с дексаметазоном. Эта тройная комбинация успешно справляется с острой тошнотой и рвотой у большинства больных. Проблемой остается отсроченная тошнота и рвота, возникающая на вторые сутки и далее после введения препаратов.
Исторически для купирования отсроченной тошноты и рвоты использовали дексаметазон. В 2006 году Международная организация по сопроводительной терапии при злокачественных опухолях (MASCC) рекомендовала назначение дексаметазона или апрепитанта для купирования отсроченной тошноты и рвоты. Включение апрепитанта было обосновано его способностью уменьшать частоту развития отсроченной тошноты и рвоты по сравнению с ондансетроном при профилактике острой рвоты у больных, получавших цисплатин-содержащие режимы. С учетом того, что ондансетрон оказывает минимальное влияние на профилактику отсроченной тошноты и рвоты, реальная эффективность апрепитанта не была установлена.
Это послужило основанием для проведения исследования для оценки способности апрепитанта в сравнении с дексаметазоном предотвращать развитие отсроченной тошноты и рвоты у больных раком молочной железы, которые получали комбинацию доксорубицина и циклофосфамида (60/600 мг/м2). Все больные получали одинаковую профилактику острой тошноты и рвоты, которая подразумевала назначение апрепитанта в дозе 125 мг внутрь за час до введения химиотерапии, палоносетрона 0,25 мг в/в струйно и дексаметазон 8 мг в/в капельно за 30 минут до введения. В дальнейшем пациенты были рандомизированы в две группы, одна из которых получала дексаметазон 4 мг внутрь 3 раза в день 2-3 дни, а другая апрепитант 80 мг внутрь на 2 и 3 дни. Лечение было двойным слепым. Основным критерием эффективности была частота отсутствия тошноты и рвоты на 2-5 дни после проведения терапии.
В исследование была включена 551 больная, из которых 273 получали дексаметазон, а 278 – апрепитант. Частота полного контроля острой тошноты и рвоты составила 87,6% и 84,9% в группе дексаметазона и апрепитанта соответственно. Частота отсутствия тошноты и рвоты в период 2-5 дней лечения составила 79,5% для обеих групп. Одновременно отмечена тенденция возникновения более выраженной тошноты и рвоты большей продолжительностью с большим числом эпизодов рвоты в группе апрепитанта по сравнению с дексаметазоном. В группе дексаметазона достоверно чаще отмечали развитие бессонницы и сердцебиений, а в группе апрепитанта – потерю аппетита и сонливость. Качество жизни в обеих группах существенно не отличалось.
Результаты исследования убедительно демонстрируют равную эффективность дексаметазона и апрепитанта для профилактики отсроченной тошноты и рвоты у больных, получивших комбинацию доксорубицина и циклофосфамида. Важным итогом данного исследования является изменение рекомендаций MASCC по профилактике отсроченной тошноты и рвоты. Вместо прежней рекомендации использовать дексаметазон либо апрепитант следует использовать дексаметазон. Несмотря на равную частоту полного контроля тошноты и рвоты в обеих группах, в группе дексаметазона отмечено меньшее число эпизодов рвоты с меньшей продолжительностью. Другим преимуществом дексаметазона является цена, которая примерно в 10 раз ниже, чем у апрепитанта. Остается неизвестным, способна ли комбинация дексаметазона и апрепитанта улучшить частоту контроля отсроченной тошноты и рвоты по сравнению с только дексаметазоном.
Ключевые слова: тошнота и рвота, дексаметазон, апрепитант, рак молочной железы.
Литература
- Roila F, Ruggeri B, Ballatori E, Del Favero A, Tonato M. Aprepitant versus dexamethasone for preventing chemotherapy-induced delayed emesis in patients with breast cancer: a randomized double-blind study.
J. Clin. Oncol. 2013, vol.32: 101-104.
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Источник

Послеоперационная тошнота и рвота (ПОТиР) — частое осложнение, сопровождающееся дискомфортом у пациента и увеличением длительности и стоимости лечения. Частота развития послеоперационной тошноты и рвоты составляет 50 и 30 % соответственно. При наличии у пациента нескольких факторов риска частота ПОТиР достигает 80 %.
Идентификация пациентов с рисками развития ПОТиР
Выделяют ряд факторов, имеющих доказанную связь с развитием ПОТиР:
- Женский пол;
- ПОТиР либо кинетозы (болезнь движения) в анамнезе;
- Некурящие пациенты;
- Молодой возраст < 50 лет;
- Общая анестезия;
- Использование ингаляционных анестетиков и закиси азота;
- Применение в послеоперационном периоде опиоидов;
- Длительность анестезии;
- Тип хирургического вмешательства (холецистэктомия, лапароскопия, гинекологические операции).
Некоторые факторы имеют противоречивые данные о связи с ПОТиР: менструальный цикл, уровень опытности анестезиолога, класс по ASA, использование антагонистов миорелаксантов.
Доказано, что постановка назогастрального зонда, ожирение и дополнительная кислородотерапия не оказывают влияния на развитие ПОТиР.
На основании данных факторов риска составлены шкалы риска ПОТиР:
В данной шкале риска учитываются следующие факторы: женский пол, статус курения, анамнез ПОТиР, послеоперационное использование опиоидов. При наличии 0, 1, 2, 3 и 4 факторов частота развития ПОТиР составляет 10, 20, 40, 60 и 80% соответственно.
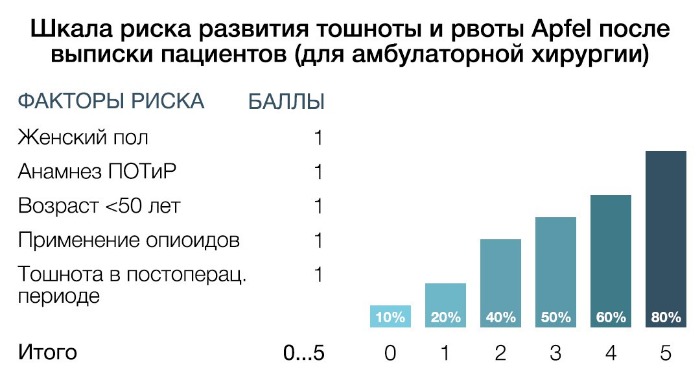
В данной шкале риска учитываются следующие факторы: женский пол, анамнез ПОТиР, возраст < 50 лет, использование опиоидов в послеоперационном периоде, развитие тошноты в послеоперационном отделении. При наличии 0, 1, 2, 3, 4 и 5 факторов частота развития ПОТиР составляет 10, 20, 30, 50, 60 и 80 % соответственно.
Ввиду трудности выявления тошноты у детей определяется риск развития рвоты. В данной шкале риска учитываются следующие факторы: длительность операции (≥ 30 мин), возраст ≥ 3 лет, операции по поводу косоглазия, ПОР или ПОТиР в анамнезе. При наличии 0, 1, 2, 3 и 4 факторов частота развития ПОТиР составляет 10, 10, 30, 50 и 70 % соответственно.
Используя вышепредставленные шкалы, пациенты разделяются на группы риска:
- Низкий риск (0‒1 фактор);
- Умеренный риск (2 фактора);
- Высокий риск (3 и более факторов).
От категории риска зависит дальнейшая тактика анестезиолога в предупреждении и лечении ПОТиР.
Уменьшение базового уровня риска развития ПОТиР
Для уменьшения базового риска ПОТиР необходим комплексный подход к ведению пациента во время периоперационного периода. Необходимо оценить преимущества и недостатки методов анестезии. Известно, что при проведении регионарной анестезии частота развития ПОТиР значительно меньше, чем при использовании ингаляционных анестетиков и закиси азота. Также использование пропофола для индукции и поддержания анестезии достоверно уменьшает частоту ПОТиР.
Поддержание адекватной гидратации пациента (объем инфузии 30 мл/кг) во время операции уменьшает частоту ПОТиР. Снижение использования опиоидов возможно с помощью применения других препаратов для достижения анальгезии: нестероидных противовоспалительных средств (НПВС) и ингибиторов ЦОГ-2, кетамина в интраоперационном периоде. Однако, данные препараты имеют собственные ограничения и противопоказания к применению.
Профилактика развития ПОТиР
Профилактика проводится всем пациентам вне зависимости от риска развития ПОТиР. Профилактика включает комбинацию препаратов из разных групп антиэметиков и мероприятия по снижению базального уровня риска:
- низкий риск — снижение базального уровня риска + тактика «ждать и наблюдать»;
- средний риск — 1—2 препарата либо 1 препарат + тотальная внутривенная анестезия (ТВА);
- высокий риск — 2 препарата различных групп + ТВА.
Классы противорвотных препаратов (антиэметиков):
1. Антагонисты рецепторов 5-HT3 (5-гидрокситриптамина)
Данная группа включает такие препараты, как ондансетрон, доласетрон, гранисетрон, трописетрон, рамосетрон и палоносетрон. Ондансетрон является «золотым стандартом» в сравнении с другими антиэметиками. Максимальная эффективность наблюдается при введении данных препаратов во время окончания оперативного вмешательства, кроме палоносентрона, который чаще вводится во время индукции анестезии.
Данная группа имеет благоприятный профиль побочных эффектов. При использовании антагонистов рецепторов 5-HT3 есть риск удлинения интервала QT, ввиду этого FDA ограничила дозу ондансетрона для лечения тошноты и рвоты до 16 мг однократно.
2. Антагонисты рецепторов NK-1 (нейрокинин-1)
Новый класс антиэметиков, к которому относятся апрепитант, касопитант, релопитант. Клинические испытания показали, что антиэметический эффект данных препаратов сопоставим с эффектом ондансетрона в дозировке 4 мг. Доказано усиление эффекта при использовании комбинации касопитанта с ондансетроном.
3. Кортикостероиды
Дексаметазон эффективно предупреждает развитие тошноты и рвоты в послеоперационном периоде. Профилактические дозы 4–5 мг в/в применяются у пациентов повышенного риска в начале операции. Использование доз > 0,1 мг/кг дексаметазона уменьшает послеоперационную боль, снижает потребность в опиоидах, частоту развития тошноты и рвоты. Метилпреднизолон более эффективен в предупреждении поздней ПОТиР.
Возможно повышение уровня глюкозы крови через 6–12 часов после применения дексаметазона в дозе 8 мг. Требуется осторожное использование препарата у пациентов с нарушениями толерантности к глюкозе, сахарным диабетом второго типа, ожирением. Применение дексаметазона однократно в профилактических дозах (4–8 мг) не вызывает повышения риска развития инфекционных осложнений со стороны операционной раны.
4. Бутирофеноны
Из данного класса препаратов для профилактики ПОТиР используются дроперидол и галоперидол. В 2001 году FDA внесла дроперидол в «black box» в связи с частым развитием побочных эффектов (удлинение интервала QT, развитие жизнеугрожающих аритмий).
Дроперидол в низких дозах < 1 мг или 0,15 мкг/кг в/в показал хорошую антиэметическую активность (сопоставимую с ондансетроном и дексаметазоном) и низкую частоту побочных эффектов. Комбинация дроперидола и ондансетрона показала большую эффективность, чем оба препарата по отдельности.
Галоперидол в низких дозах может использоваться как альтернатива дроперидолу. Дозы, значительно меньшие используемых в психиатрии (0,5–2 мг), обладают хорошим антиэметическим эффектом. При использовании данных доз не развивается значительной седации, а риск развития аритмий остается невысоким.
5. Антигистаминные препараты
Дименгидринат — антигистаминное средство с антиэметическим эффектом. Рекомендованные дозы 1 мг/кг в/в вызывают сравнимый эффект с ондансетроном, дроперидолом и дексаметазоном. На данный момент нет достаточных данных об оптимальном режиме введения и дозирования препарата, а также о профиле побочных реакций.
6. Антихолинергические препараты
В дополнение к антиэметической терапии может использоваться трансдермальный пластырь, содержащий скополамин (ТДПС). Его использование эффективно предупреждает развитие ПОТиР в течение 24 часов после операции. Пластырь прикрепляется за 2–4 часа до операции. Побочные эффекты применения скополамина включают: нарушения зрения, сухость губ, головокружение.
7. Фенотиазины
В данную группу входят препараты перфеназин и метоклопрамид. Метоклопрамид имеет слабый антиэметический эффект и в дозе около 10 мг не оказывает значительного влияния на частоту развития ПОТиР. Для снижения частоты ПОТиР необходимо использовать дозы более 20 мг, что приводит к увеличению частоты развития дискинезии и экстрапирамидных расстройств вплоть до 0,6 %.
8. Другие антиэметики
- Пропофол;
- Альфа-2-агонисты: клонидин и дексмедетомидин;
- Миртазапин;
- Габапентин;
- Мидазолам.
Профилактические дозы препаратов и время введения для взрослых
1. Во время индукции анестезии:
- Aprepitant 40 мг per os;
- Casopitant 150 мг per os;
- Dexamethasone 4–5 мг в/в;
- Palonosetron 0,075 мг в/в;
- Rolapitant 70–200 мг per os.
2. В конце операционного вмешательства:
- Ramosetron 0,3 мг в/в;
- Dolasetron 12,5 мг в/в;
- Tropisetron 2 мг в/в;
- Ondansetron 4 мг в/в, 8 мг под язык;
- Granisetron 0,35–3 мг в/в;
- Droperidol 0,625–1,25 мг в/в.
3. До операционного вмешательства, в составе премедикации:
- Haloperidol 0,5–2 мг в/м в/в;
- Methylprednisolone 40 мг в/в;
- Perphenazine 5 мг в/в;
- Promethazine 6,25–12,5 мг в/в;
- Ephedrine 0,5 мг/кг в/м;
- Dimenhydrinate 1 мг/кг в/в;
- Scopolamine трансдермальный пластырь, за 2 часа до оперативного вмешательства.
Профилактические дозы препаратов для детей
- Dexamethasone 150 мкг/кг максимально 5 мг;
- Dimenhydrinate 0,5 мг/кг максимально 25 мг;
- Dolasetron 350 мкг/кг максимально 12,5 мг;
- Droperidol 10–15 мкг/кг максимально 1,25 мг;
- Granisetron 40 мкг/кг максимально 0,6 мг;
- Ondansetron 50–100 мкг/кг максимально 4 мг;
- Tropisetron 0,1 мг/кг максимально 2 мг.
Частые комбинации препаратов для профилактики ПОТиР
1. Взрослые:
- Droperidol + Dexamethasone;
- антагонист рецепторов 5-HT3 + Dexamethasone;
- антагонист рецепторов 5-HT3 + Droperidol;
- антагонист рецепторов 5-HT3 + Dexamethasone + Droperidol;
- Ondansetron + Casopitant.
2. Дети:
- Ondansetron 0,05 мг/кг +Dexamethasone 0,015 мг/кг;
- Ondansetron 0,1 мг/кг + Droperidol 0,015 мг/кг;
- Tropisetron 0,1 мг/кг + Dexamethasone 0,5 мг/кг.
Немедикаментозные методы профилактики
Имеются данные о том, что стимуляция различными методиками точки P6 (дистальная треть предплечья), и срединного нерва с помощью титанической стимуляции снижают частоту развития ПОТиР в раннем послеоперационном периоде. Данные методы рекомендуется применять до либо после индукции анестезии. Эффект стимуляции сопоставим с применением распространенных антиэметиков и не зависит от возраста и инвазивности методики.
Лечение развившихся ПОТиР
При развитии ПОТиР терапия должна проводиться антиэметиками из фармакологического класса, не использовавшегося при периоперационной профилактике.
Профилактика ПОТиР не проводилась:
- Низкие дозы антагонистов рецепторов 5-HT3 (ондансетрон 1,0 мг; гранисетрон 0,1 мг; трописетрон 0,5 мг);
- Альтернативой является применение дексаметазона 2–4 мг в/в, дроперидола 0,625 мг в/в или прометазина 6,25–12,5 мг в/в.
Профилактика ПОТиР проводилась:
- При развитии ПОТиР спустя > 6 часов после оперативного вмешательства возможно повторное введение короткодействующих препаратов: ондансетрон 4 мг для взрослых и 0,1 мг/кг для детей или дроперидол 1 мг для взрослых 10–15 мкг/кг для детей;
- Не рекомендуется повторное введение длительнодействующих препаратов: дексаметазона, ТДПС, апрепитанта, палоносетрона.
При неэффективности предыдущего этапа:
- Дименгидринат 1 мг/кг для взрослых и 0,5–1,0 мг/кг для детей;
- При отсутствии эффекта используются препараты других групп, не применявшиеся ранее.
При развитии ПОТиР необходимо исключить механические и лекарственные причины тошноты и/или рвоты: высокие дозы опиоидов, затекание крови и/или других жидкостей в гортань (часто после тонзилэктомии), кишечную непроходимость.
Источник:
Gan, Tong J.; Diemunsch, Pierre; Habib, Ashraf S.; Kovac, Anthony “Consensus Guidelines for the Management of Postoperative Nausea and Vomiting” Anesthesia & Analgesia: January 2014 – Volume 118 – Issue 1 – p 85–113
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Представлены данные сравнения эффективности различных доз дексаметазона (4 и 12 мг), используемых в качестве профилактики интраоперационной тошноты и рвоты, в 2 группах (102 женщины). В 1-й группе (51 женщина) в качестве средства премедикации использовали 4 мг дексаметазона, во 2-й группе (51 женщина) — 12 мг дексаметазона. Полученные результаты свидетельствуют о большей степени риска появления интраоперационной тошноты и рвоты во 2-й группе (12 мг) при отсутствии статистически достоверных различий между исследованными группами.
Наше предыдущее исследование, посвященное сравнению эффективности различных методов премедикации, включающих метоклопрамид и дексаметазон, в профилактике интраоперационной тошноты и рвоты (ИОТР) при выполненииспинномозговой анестезии (СА) кесарева сечения, показало наибольшую эффективность дексаметазона [1]. И хотя дексаметазон применяется какантиэмитическое средство, вопрос о выборе оптимальной дозы для профилактики ИОТР вообще и в акушерстве в частности по-прежнему является предметом дискуссий [5].
Цель исследования — сравнение эффективности различных доз дексаметазона (4 и 12 мг) в профилактике ИОТР при выполнении СА кесарева сечения.
Материал и методы исследования
была сформирована выборка из 102 беременных, которая была разбита на 2 группы. Включение пациенток в ту или иную группу проведено методом рандомизации. Был использован генератор случайных чисел 1 и 2, чтобы получить ряд, в соответствии с которым каждой поступающей пациентке назначается одна из доз дексаметазона (4 и 12 мг соответственно). Пронумерованы100 конвертов и в них вложены назначения доз в соответствии с числом (1 или 2), указанным в сгенерированном ряду.
Для профилактики ИОТР за 10 мин до проведения СА пациенткам внутривенно вводили дексаметазон: в 1-й группе (51 беременная) — 4 мг, во 2-й группе (51 беременная) – 12 мг.
Статистический анализ полученных данных включал описательную статистику по каждому исследуемому показателю, а также проверку гипотезы о статистической значимости различия средних значений 2 групп с помощью критерия Стьюдента при уровне значимости, равном 0,05. Для сравнения частот осложнений были рассчитаны частотные характеристики выборок в обеих группах, относительный риск (ОР) и 95% доверительный интервал ОР. Вся процедура обработки данных выполнена с использованием программного пакета Microsoft Office Excel 2007.
Средний возраст рожениц 1-й и 2-й групп статистически значимо не различался и во всей выборке составил 28,35±0,48 года (табл.1).
Оперативное вмешательство осуществлялось при сроке гестации 39,07 ± 0,07 нед. Статистически достоверных различий средних значений срока гестации между группами не отмечено (табл. 2).
Также не обнаружено статистически значимых различий между группами по средним показателям роста и массы тела женщин (табл. 3).
Инфузионную терапию перед СА проводили в режиме терапевтической гемодилюции 0,9% раствором хлорида натрия в объеме 500 мл. Пункции выполнялись на уровнях LII– LIII и LIII – LIV в положении пациентки сидя.
Для достижения спинномозгового блока использовали 0,5% изобарический раствор бупивакаина в дозе 2,65 ± 0,02 мл (табл. 4).
Во время анестезии в обеих группах проводили постоянную ингаляцию увлажненного кислорода (3 л/мин), измерение артериального давления (АД), частоты сердечных сокращений, насыщения гемоглобина кислородом с помощью монитора Philips M35. АД измеряли через каждые 2 мин до извлечения плода и в последующем через каждые 5 мин до перевода родильницы в палату.
Не обнаружено статистически достоверных различий средних значений исходного АД между исследуемыми группами (табл. 5).
Оперативный доступ выполнялся из разреза по Пфанненштилю (79 случаев), либо нижнесрединной лапаротомии (23 случая). Объем оперативного вмешательства: в 96 случаях кесарево сечение и в 6 случаях кесарево сечение со стерилизацией.
Средняя продолжительность операций составила 24,32 ± 0,57 мин. Статистически достоверных различий между исследуемыми группами по средним показателям продолжительности операции и объема кровопотери не наблюдалось (табл. 6).
Не обнаружено статистически значимых различий между средними значениями оценок состояния ребенка по шкале Апгар в 2 исследуемых группах (табл. 7и табл. 8).
Таким образом, исследуемые группы были статистически однородны по возрастным, антропометрическим и акушерским характеристикам. У всех беременных в исследуемых группах (n=102) операция и анестезия протекали без осложнений. У всех пациенток был достигнут адекватный уровень анестезии, развитие сенсорного блока
было в пределах ThIV –ThVI . Статистически значимых различий между исследуемыми группами по изменению гемодинамики также не наблюдалось. В качестве параметра изменения гемодинамики была принята разность между максимальным и минимальным значениями АД за период операции у каждой пациентки (табл. 9).
Результаты исследования и обсуждение
Данные об эффективности премедикации дексаметазоном в профилактике ИОТР представлены в табл. 10. ОР ИОТР в группе женщин, которым вводили 12 мг дексаметазона (2-я), по сравнению с группой пациенток, получивших в качестве премедикации 4 мг препарата (1-я), составил 2,00(95% ДИ: 0,22—5,14). Это означает, что частота ИОТР во 2-й группе в 2 раза выше, чем в 1-й группе. Но, поскольку 95% доверительный интервал ОР содержит 1, говорить о статистической достоверности различий не представляется возможным.
Тошнота и рвота — явления достаточно частые во время кесарева сечения и в раннем послеоперационном периоде. В действительности, есть несколько физиологических изменений, связанных с беременностью и родами, которые могут предрасполагать к возникновению рвоты у рожениц и родильниц [4]. Например, задержка опорожнения желудка, повышенная секреция гастрина плацентой, расслабление пищеводного сфинктера и аортокавальная компрессия. Во время кесарева сечения под нейроаксиальной анестезией могут присутствовать ятрогенные факторы, которые приводят к тошноте или рвоте, например, выведение матки в рану, артериальная гипотония, симпатэктомия, применение утеротонических препаратов, антибиотиков или опиоидов [3].
Опубликованные на сегодняшний день результаты исследований позволяют считать, что рвота, возникающая как интраоперационно, так и в послеоперационном периоде, не является «рентабельным» осложнением. В равной степени важны как высокий уровень дискомфорта больных и их недовольство качеством проведения анестезии, так и вероятность возникновения более серьезных осложнений — аспирации и усиления боли в раннем послеоперационном периоде. Следует отметить, что в некоторых странах большая часть больных желают заплатить 100 долларов США из своего кармана за эффективное противорвотное средство [2]. В акушерстве трудно исповедовать столь популярный сегодня мультимодальный подход к профилактике этого осложнения, и не столько с фармакоэкономических, сколько с юридических позиций. Любое лекарственное средство проходит долгий путь, прежде чем будет разрешено к применению у беременной или кормящей женщины. Из-за продолжающегося сокращения финансовых ресурсов в будущем станет необходимо обращать внимание на экономические преимущества обширной стратегии профилактики различных осложнений СА и отбирать только те препараты и их дозировки, которые являются по-настоящему эффективными, безопасными и рентабельными. Профилактику рвоты не стоит делать самоцелью или стремиться заместить ее другими проблемами, такими, как, например, послеоперационная дисфория (из-за назначения высокой дозы нейролептиков) или экстрапирамидные нарушения, возникшие вследствие применения метоклопрамида. Усилия должны быть направлены на улучшение самочувствия пациентки, ведущее к повышению качества жизни и в итоге к удовлетворенности женщины качеством проведения анестезии.
Выводы
1. При оценке эффективности различных доз дексаметазона статистически достоверных различий не выявлено.
2. Различия между минимальными и максимальными цифрами АД (и систолического, и особенно диастолического) во время операции невелики, что говорит о перспективности изучения дексаметазона как средства премедикации при кесаревом сечении в условиях нейроаксиальных методов обезболивания.
1. Погодин А.М., Шифман Е.М. Профилактика тошноты и рвоты при спинномозговой анестезии во время операции кесарева сечения // Регионарная анестезия и лечение острой боли. — 2009. — Т.3, N 1. — С. 11—15.
2. Balki M., Carvalho J.C.A. Intraoperative nausea andvomiting during caesarean section under regionalanesthesia // Int. J. Obstet. Anesth. — 2005. — Vol. 14. — P. 230—241.
3. Bucklin B.A., Hawkins J.L., Anderson J.R., Ulrich F.A. Obstetric anesthesia work force survey: twenty-yearupdate // Anesthesiology. — 2005. — Vol.103. — P. 645—653.
4. Gan T., Sloan F., Dear G. How much are patientswilling to pay avoid postoperative nausea andvomiting? // Anesth. Analg. — 2001. — Vol. 92. — Р. 393—400.
5. Skledar S.J., Williams B.A., Vallejo M.C. Eliminatingpostoperative nausea and vomiting in outpatientsurgery with multimodal strategies including lowdoses of nonsedating, off-patent antiemetics: is«zero tolerance» achievable? // Scient. Wld J. — 2007. — Vol. 12. — № 7. — P. 959—977.
Шифман Ефим Муниевич, д-р мед. наук, проф., зам. дир. по лечебной работе ФГУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздравсоцразвития РФ
Адрес: 117997, Москва, ул. Академика Опарина, д. 4
E-mail: ncagp@bk.ru
Источник
