Профилактика рвоты после операции
, ,
Ни одно из доступных противорвотных средств не обладает 100% эффективностью в профилактике ПОТР, особенно у пациентов высокой степени риска их развития. Более 40 рандомизированных исследований свидетельствуют, что комбинированная (с применением 2 и более лекарственных средств) профилактика ПОТР, особенно с учётом основного механизма их реализации, значительно эффективнее монопрофилактики. Учитывая многофакторную этиологию ПОТР, для определения наиболее рациональной комбинации в каждом конкретном случае необходимо построение пошагового полимодального алгоритма.
Шаг I. Определение степени риска ПОТР
Специфические факторы риска
ü Женский пол (IA)
ü Некурящие больные (IVA)
ü ПОТР в анамнезе/укачивание в транспорте (IVA)
Анестезиологические факторы риска
ü Применение ингаляционных анестетиков в пределах двух часов (IA)
ü Использование закиси азота (IIA)
ü Применение в интраоперационном (IIA) и послеоперационном периодах опиоидов (IVA)
Хирургические факторы риска
ü Продолжительность операции (каждые 30 минут сверх среднестатистического времени, затрачиваемого на операцию увеличивают риск ПОТР на 60%; IVA)
ü Тип операции (лапароскопические, реконструктивно-восстановительные, ЛОР-операции, нейрохирургические, операции на молочной железе, по поводу косоглазия, лапаротомия; IVB)
Шаг II. Уменьшение факторов риска развития ПОТР
Пути уменьшения факторов риска включают:
ü Использование регионарной анестезии (IIIA)
ü Использование пропофола для индукции и поддержания анестезии (IA)
ü Респираторная поддержка (ИВЛ) с FiO2 не ниже 0,8 (IIIB)
ü Адекватная интраоперационная инфузионная терапия (IIIA)
ü Исключение из схемы анестезии закиси азота (IIA)
ü Исключение применения ингаляционных анестетиков (IA)
ü Применение адъювантов с целью уменьшения доз опиоидов на интраоперационном (IIA) и послеоперационном (IVA) этапах
ü Исключение декураризации (IIA)
Шаг III. Применение для профилактики и лечения ПОТР
Серотониновые (5-HT3) антагонисты:
– Ондансетрон (IA)
– Доласетрон (IA)
– Гранисетрон (IA)
– Трописетрон (IA)
– Рамосетрон
Альтернативные средства из различных фармакологических групп:
Дексаметазон (IIA)
Дроперидол (IA)
Дименгидринат (IIA)
Эфедрин (IIIB)
Прохлорперазин (IIIA)
Пипольфен (IIIB)
Трансдермальное введение скополамина (IIB)
Галидор
Клонидин
Нефармакологические методы
Иглоукалывание (IIA)
Гипноз (IIIB)
Пошаговый анализ позволяет представить алгоритм в виде схемы (рис.1).
Рисунок 1. Алгоритм профилактики ПОТР в абдоминальной хирургии.
Примечания. При выборе средств для профилактики – заключительный этап алгоритма, необходимо руководствоваться следующими принципами:
ü если операция сопровождается травмой энтерохромаффинных клеток – базовый препарат блокатор 5-HT3 рецепторов.
ü если многокомпонентная анестезия предусматривает применение холинолитиков (премедикация), дроперидола и клонидина (анальгезия и НВТ у больных с исходно высоким тонусом САС) – анестезия должна быть максимально сбалансирована с учётом эффекта этих препаратов.
ü если необходима комбинация двух препаратов, первый должен быть блокатор 5-HT3 рецепторов, второй – смотри предыдущий пункт, однако, например, у больных с сопутствующей бронхиальной астмой приоритет применения глюкокортикоидов, у больных с атеросклерозом и остеохондрозом шейного отдела позвоночника – галидора и высокого FiO2 и т. д.
ü если риск развития ПОТР максимально высок, помимо вышеперечисленных, появляются жёсткие показания к применению анестетиков с антиэмической активностью.
Шаг IV. Лечение ПОТР у пациентов, которым не была проведена профилактика или она оказалась не эффективной
Исключить препараты и/или механические причины, провоцирующие ПОТР (V)
Терапия у больных, которым не проводили профилактику:
ü При появлении первых признаков синдрома ПОТР, проводят лечение, идентичное профилактике или вводят дексаметазон внутривенно
ü антагонист 5-HT3-реципторов*, плюс альтернативное средство**
ü «Тройная» терапия: антагонист 5-HT3-рецепторов*, плюс два альтернативных средства** (если ПОТР появились больше чем через 6 часов после операции не применять дексаметазон и трансдермальное введение скополамина) (V)
При не эффективной профилактике:
ü Применяют малую дозу антагониста 5-HT3-рецепторов* (IIA)
ü Используют альтернативное средство** (наиболее показанное по совокупности, см. примечания рис. 3) (V)
ü Не повторяют препараты, оказавшиеся не эффективными для профилактики (IIIA).
Если ПОТР появились меньше, чем через 6 часов после операции, применяют: альтернативное средство** плюс пропофол 0,5 мг/кг (20 мг) в/в (IIIB).
Если прошло более 6 часов после операции:
– повторяют антагонист 5-HT3-рецепторов*, плюс дроперидол, если последнее его введение было больше чем 6 часов назад (дексаметазон или трансдермальное введение скополамина не применяют)
– используют альтернативное средство** (V)
Примечания:
* малые дозы антагонистов 5-HT3-рецепторов: ондансетрон 1,0 мг; доласетрон 12,5 мг; гранисетрон 0,1 мг; трописетрон 0,5 мг;
** альтернативные препараты из разных фармакологических групп: дроперидол 0,5 мг в/в; дексаметазон 2-4 мг в/в; пипольфен 12,5 мг в/в.
– в скобках указаны критерии или уровни доказательности.
Проблему послеоперационной тошноты и рвоты следует считать одной из важнейших в современной анестезиологии. Трописетрон, ондансетрон и гранисетрон в настоящее время являются наиболее эффективными средствами предотвращения этого осложнения, если ведущим механизмом его развития является стимуляция 5-HT3 рецепторов, а пропофол и фентанил – оптимальное сочетание препаратов для комбинированной анестезии, применение которых сопровождается наименьшей частотой ПОТР. В случае высокого риска развития ПОТР, необходимо пошаговое полимодальное построение индивидуального алгоритма их профилактики.
1. , Мартынов В. А., , Мамонтова развития тошноты и рвоты после проведения лапароскопической холецистэктомии. // Вестник РГМУ. – 2000. – №3 (13). – С. 15-20.
2. , А, и др. Галидор в профилактике послеоперационной рвоты у больных с шейным остеохондрозом после лапароскопических холецистэктомий. // Вестн. Интенивн. терапии. – 1998. – №4. – С. 13-14.
3. Мартынов анестезиологического обеспечения лапароскопической холецистэктомии: Дисс… канд. мед. наук: 14.00.37. – М., 2000.
4. , Молчанов антиэмитический эффект дексаметазона при эндоскопической холецистэктомии. // Вестн. Интенивн. терапии. – 2001. – №3. – С. 33-35.
5. , , Прохоров болевой синдром в онкологии. – М.: Медицина. – 1998. – С. 41-44.
6. , Ивашкин и рвота в гастроэнтерологической практике. // РМЖ, БОП. – 2001. – Том 3. – № 1.
7. Aapro M. S., Alberts D. S. Dexamethasone as an antiemetic in patients treated with cisplatin (Letter). // N. Engl. J. Med. – 1981. – 305: 520.
8. Alon E., Himmelseher S. Ondansetron in the treatment of postoperative vomiting: a randomized, double-blind comparison with droperidol and metoclopramide. // Anesth. Analg. – 1992. – Vol. 75(4). – P. 561-565.
9. Apfel C. C., Greim C. A., Haubitz I., et al. A risk score to predict the probability of postoperative vomiting in adults. // Acta Anaesthesiologica Scandinavica. – 1998. – Vol. 42. – P. 495-501.
10. Cabrera J. C., Matute E., Escolano F., et al. Efficacy of ondansetron in the prevention of nausea and vomiting after laparoscopic cholecystectomy. // Rev Esp Anestesiol Reanim. – 1997. – Vol. 44(1). – P. 36-8.
11. Camu F., Lauwers M. H., Verbessem D. Incidence and aetiology of postoperative nausea and vomiting. // Eur. J. Anaesthesiol. – 1992. – Vol. 9. Suppl 6. – P. 25-31.
12. Carroll N. V., Miederhoff P. A., Cox F. M., Hirsch J. D. Costs incurred by outpatient surgical centers in managing postoperative nausea and vomiting. // J. Clinical Anesthesia. – 1994. – Vol. 6. – P. 364-9.
13. Dicato M. A., Freeman A. J. Experience with ondansetron in chemotherapy – and radiotherapy-induced emesis. // Eur J Anaesth. – 1992. – Vol. 6. – P. 19-24.
14. Fan C. F., Tanhui E., Joshi S., et al. Acupressure treatment for prevention of postoperative nausea and vomiting. // Anesth. Analg. – 1997. – Vol. 84(4). – P. 821-825.
15. Fander J. W. 4Mineralocorticoid receptors and glucocoricoid receptors. // Clin. Endocrinol., 1996, 45, 651-656.
16. Fujii Y., Tanaka H. Postoperative anti-emetic effects of low dose droperidol. // Masui. – 1993. – Vol. 42(5). – P. 694-697.
17. Fujii Y., Tanaka H., Toyooka H. Granisetron reduces the incidence and severity of nausea and vomiting after laparoscopic cholecystectomy. // Can. J. Anaesth. – 1997. – Vol. 44(4). – P. 396-400.
18. Gan T. J., Ginsberg B., Grant A. P., et al. Double-blind, randomized comparison of ondansetron and intraoperative propofol to prevent postoperative nausea and vomiting. // Anesthesiology. – 1996. – Vol. 85(5). – P. 1036-42.
19. Gibbons P. A., Nicolson S. C., Betts E. K., et al. Scopolamine does not prevent postoperative emesis after pediatric eye surgery. // Anesthesiology. – 1984. – Vol. 61. – P. 435.
20. Harris S. N., Sevarino F. B., Sinatra R. S., et al. Nausea prophylaxis using transdermal scopolamine in the setting of patient controlled analgesia. // Obst. Gynaecol. – 1991. – Vol. 78. – P. 673-677.
21. Heath K. J., Sadler P., Winn J. H., et al. Nitrous oxide reduces the cost of intravenous anaesthesia. // Eur J Anaesth. – 1996. – Vol. 13(4). – P. 369-72.
22. Iitomi T., Toriumi S., Kondo A., et al. Incidence of nausea and vomiting after cholecystectomy performed via laparotomy or laparoscopy. // Masui. – 1995. – Vol. 44(12). – P. 1627-31.
23. Ionescu D., Badescu C., Maican D., Acalovschi I. Does smoking have an influence on PONV? // Eur J Anaesth. – 2000. – Vol. 17. – P. 783-784.
24. Italian Group for Antiemetic Research. 5Dexamethasone, granisetron, or both for the prevention of nausea and vomiting during chemotherapy for cancer. // N. Engl. J. Med., 1995, 332: 1-5.
25. Italian Group for Antiemetic Research. 6Ondansetron versus metoclopramide, both combined with dexamethasone, in the prevention of cisplatin-induced delayed emesis. // J. Clin. Oncol., 1997, 15: 124-130.
26. Kapur P. A. Editorial: The big little problem. // Anesthesia and Analgesia. – 1991. – Vol. 72. – P. 243-245.
27. Karabiyik L., Bozkirli F., Celebi H., et al. Effect of nitrous oxide on middle ear pressure: a comparison between inhalational anaesthesia with nitrous oxide and TIVA. // Eur J Anaesth. – 1996. – Vol. 13(1). – P. 27-32.
28. Katzung B. G. Basic & Clinical Parmacology. Stamford, Connecticut. Appleton & Lange. – 1998.
29. Larsson S., Lundberg D. A prospective survey of postoperative nausea and vomiting with special regard to incidence and relations to patient characteristics, anesthetic routines and surgical procedures. // Acta. Anaesthesiol. Scand. – 1995. – Vol. 39(4). – P. 539-545.
30. Marley R. A. Postoperative nausea and vomiting: the outpatient enigma. // J. Perianesth. Nurs. – 1996. – Vol. 11(3). – P. 147-161.
31. Miller A. D., Leslie R. A. The area postrema and vomiting. // Front Neuroendocrinol. – 1994. – Vol. 15(4). – P. 301-20.
32. Minami M., Endo T., Hirafuji M. Role of serotonin in emesis. // Nippon. Yakurigaku. Zasshi. – 1996. – Vol. 108(5). – P. 233-242.
33. Morimoto M., Morita N., Ozawa H., et al. 7Distribution of glucocorticoid receptor immunoreactivity and mRNA in the rat brain: an immunohistochemical and in situ hydridization stydy. // Neurosci. Res., 1996, 26: 235-269.
34. Naylor R. J., Inall F. C. The physiology and pharmacology of postoperative nausea and vomiting. // Anaesthesia. – 1994. – Vol. 49. – P. 2-5.
35. Rothenberg D. M., Parnass S. M., Litwack K., et al. Efficacy of ephedrine in the prevention of postoperative nausea and vomiting. // Anesth. Analg. – 1991. – Vol. 72(1). – P. 58-61.
36. Schimmer B. P., Parker K. L. 10Adrenocorticotropic hormone; adrenocortical steroids and their synthetic analogs; inhibitors of the synthesis and actions of adrenocortical hormones. In: Hardman J. G., Limbrid L. E., Molinoff P. B., Ruddon R. W. (Eds.). Goodman and Gillman’s the Pharmacological Basis of Therapeutics, 9th ed., New York, USA: McGraw-Hill, 19–1486.
37. Schwartz C. I., Heyman A. S., Rao A. C. Prophylactic nasogastric tube decompression: is its use justified? // South. Med. J. – 1995. – Vol. 88(8). – P. 825-830.
38. Sukhani R., Lurie J., Jabamoni R. Propofol for ambulatory gynecologic laparoscopy: does omission of nitrous oxide alter postoperative emetic sequelae and recovery? // Anesthesia and Analgesia. – 1994. – Vol. 78(5). – P. 831-5.
39. Tramer M., Moore A., Mc Quay H. Propofol anaesthesia and postoperative nausea and vomiting: quantitative systematic review of randomized controlled studies. // Br. J. Anaesth. – 1997. – Vol. 78(3). – P. 247-255.
40. Trepanier C. A., Isabel L. Perioperative gastric aspiration increases postoperative nausea and vomiting in outpatients. // Can J Anaesth. – 1993. – Vol. 40(4). – P. 325-8.
41. Watcha M. F., White P. F. 13Postoperative nausea and vomiting: its etiology, treatment, and prevention. // Anesthesiology. – 1992. – Vol. 77. – P. 162-184.
Источник

Послеоперационная тошнота и рвота (ПОТиР) — частое осложнение, сопровождающееся дискомфортом у пациента и увеличением длительности и стоимости лечения. Частота развития послеоперационной тошноты и рвоты составляет 50 и 30 % соответственно. При наличии у пациента нескольких факторов риска частота ПОТиР достигает 80 %.
Идентификация пациентов с рисками развития ПОТиР
Выделяют ряд факторов, имеющих доказанную связь с развитием ПОТиР:
- Женский пол;
- ПОТиР либо кинетозы (болезнь движения) в анамнезе;
- Некурящие пациенты;
- Молодой возраст < 50 лет;
- Общая анестезия;
- Использование ингаляционных анестетиков и закиси азота;
- Применение в послеоперационном периоде опиоидов;
- Длительность анестезии;
- Тип хирургического вмешательства (холецистэктомия, лапароскопия, гинекологические операции).
Некоторые факторы имеют противоречивые данные о связи с ПОТиР: менструальный цикл, уровень опытности анестезиолога, класс по ASA, использование антагонистов миорелаксантов.
Доказано, что постановка назогастрального зонда, ожирение и дополнительная кислородотерапия не оказывают влияния на развитие ПОТиР.
На основании данных факторов риска составлены шкалы риска ПОТиР:
В данной шкале риска учитываются следующие факторы: женский пол, статус курения, анамнез ПОТиР, послеоперационное использование опиоидов. При наличии 0, 1, 2, 3 и 4 факторов частота развития ПОТиР составляет 10, 20, 40, 60 и 80% соответственно.
В данной шкале риска учитываются следующие факторы: женский пол, анамнез ПОТиР, возраст < 50 лет, использование опиоидов в послеоперационном периоде, развитие тошноты в послеоперационном отделении. При наличии 0, 1, 2, 3, 4 и 5 факторов частота развития ПОТиР составляет 10, 20, 30, 50, 60 и 80 % соответственно.
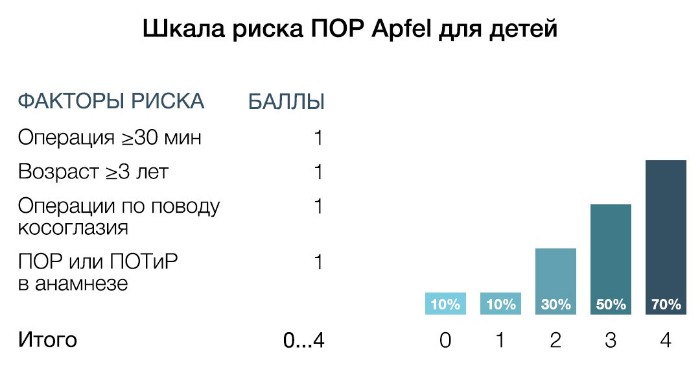
Ввиду трудности выявления тошноты у детей определяется риск развития рвоты. В данной шкале риска учитываются следующие факторы: длительность операции (≥ 30 мин), возраст ≥ 3 лет, операции по поводу косоглазия, ПОР или ПОТиР в анамнезе. При наличии 0, 1, 2, 3 и 4 факторов частота развития ПОТиР составляет 10, 10, 30, 50 и 70 % соответственно.
Используя вышепредставленные шкалы, пациенты разделяются на группы риска:
- Низкий риск (0‒1 фактор);
- Умеренный риск (2 фактора);
- Высокий риск (3 и более факторов).
От категории риска зависит дальнейшая тактика анестезиолога в предупреждении и лечении ПОТиР.
Уменьшение базового уровня риска развития ПОТиР
Для уменьшения базового риска ПОТиР необходим комплексный подход к ведению пациента во время периоперационного периода. Необходимо оценить преимущества и недостатки методов анестезии. Известно, что при проведении регионарной анестезии частота развития ПОТиР значительно меньше, чем при использовании ингаляционных анестетиков и закиси азота. Также использование пропофола для индукции и поддержания анестезии достоверно уменьшает частоту ПОТиР.
Поддержание адекватной гидратации пациента (объем инфузии 30 мл/кг) во время операции уменьшает частоту ПОТиР. Снижение использования опиоидов возможно с помощью применения других препаратов для достижения анальгезии: нестероидных противовоспалительных средств (НПВС) и ингибиторов ЦОГ-2, кетамина в интраоперационном периоде. Однако, данные препараты имеют собственные ограничения и противопоказания к применению.
Профилактика развития ПОТиР
Профилактика проводится всем пациентам вне зависимости от риска развития ПОТиР. Профилактика включает комбинацию препаратов из разных групп антиэметиков и мероприятия по снижению базального уровня риска:
- низкий риск — снижение базального уровня риска + тактика «ждать и наблюдать»;
- средний риск — 1—2 препарата либо 1 препарат + тотальная внутривенная анестезия (ТВА);
- высокий риск — 2 препарата различных групп + ТВА.
Классы противорвотных препаратов (антиэметиков):
1. Антагонисты рецепторов 5-HT3 (5-гидрокситриптамина)
Данная группа включает такие препараты, как ондансетрон, доласетрон, гранисетрон, трописетрон, рамосетрон и палоносетрон. Ондансетрон является «золотым стандартом» в сравнении с другими антиэметиками. Максимальная эффективность наблюдается при введении данных препаратов во время окончания оперативного вмешательства, кроме палоносентрона, который чаще вводится во время индукции анестезии.
Данная группа имеет благоприятный профиль побочных эффектов. При использовании антагонистов рецепторов 5-HT3 есть риск удлинения интервала QT, ввиду этого FDA ограничила дозу ондансетрона для лечения тошноты и рвоты до 16 мг однократно.
2. Антагонисты рецепторов NK-1 (нейрокинин-1)
Новый класс антиэметиков, к которому относятся апрепитант, касопитант, релопитант. Клинические испытания показали, что антиэметический эффект данных препаратов сопоставим с эффектом ондансетрона в дозировке 4 мг. Доказано усиление эффекта при использовании комбинации касопитанта с ондансетроном.
3. Кортикостероиды
Дексаметазон эффективно предупреждает развитие тошноты и рвоты в послеоперационном периоде. Профилактические дозы 4–5 мг в/в применяются у пациентов повышенного риска в начале операции. Использование доз > 0,1 мг/кг дексаметазона уменьшает послеоперационную боль, снижает потребность в опиоидах, частоту развития тошноты и рвоты. Метилпреднизолон более эффективен в предупреждении поздней ПОТиР.
Возможно повышение уровня глюкозы крови через 6–12 часов после применения дексаметазона в дозе 8 мг. Требуется осторожное использование препарата у пациентов с нарушениями толерантности к глюкозе, сахарным диабетом второго типа, ожирением. Применение дексаметазона однократно в профилактических дозах (4–8 мг) не вызывает повышения риска развития инфекционных осложнений со стороны операционной раны.
4. Бутирофеноны
Из данного класса препаратов для профилактики ПОТиР используются дроперидол и галоперидол. В 2001 году FDA внесла дроперидол в «black box» в связи с частым развитием побочных эффектов (удлинение интервала QT, развитие жизнеугрожающих аритмий).
Дроперидол в низких дозах < 1 мг или 0,15 мкг/кг в/в показал хорошую антиэметическую активность (сопоставимую с ондансетроном и дексаметазоном) и низкую частоту побочных эффектов. Комбинация дроперидола и ондансетрона показала большую эффективность, чем оба препарата по отдельности.
Галоперидол в низких дозах может использоваться как альтернатива дроперидолу. Дозы, значительно меньшие используемых в психиатрии (0,5–2 мг), обладают хорошим антиэметическим эффектом. При использовании данных доз не развивается значительной седации, а риск развития аритмий остается невысоким.
5. Антигистаминные препараты
Дименгидринат — антигистаминное средство с антиэметическим эффектом. Рекомендованные дозы 1 мг/кг в/в вызывают сравнимый эффект с ондансетроном, дроперидолом и дексаметазоном. На данный момент нет достаточных данных об оптимальном режиме введения и дозирования препарата, а также о профиле побочных реакций.
6. Антихолинергические препараты
В дополнение к антиэметической терапии может использоваться трансдермальный пластырь, содержащий скополамин (ТДПС). Его использование эффективно предупреждает развитие ПОТиР в течение 24 часов после операции. Пластырь прикрепляется за 2–4 часа до операции. Побочные эффекты применения скополамина включают: нарушения зрения, сухость губ, головокружение.
7. Фенотиазины
В данную группу входят препараты перфеназин и метоклопрамид. Метоклопрамид имеет слабый антиэметический эффект и в дозе около 10 мг не оказывает значительного влияния на частоту развития ПОТиР. Для снижения частоты ПОТиР необходимо использовать дозы более 20 мг, что приводит к увеличению частоты развития дискинезии и экстрапирамидных расстройств вплоть до 0,6 %.
8. Другие антиэметики
- Пропофол;
- Альфа-2-агонисты: клонидин и дексмедетомидин;
- Миртазапин;
- Габапентин;
- Мидазолам.
Профилактические дозы препаратов и время введения для взрослых
1. Во время индукции анестезии:
- Aprepitant 40 мг per os;
- Casopitant 150 мг per os;
- Dexamethasone 4–5 мг в/в;
- Palonosetron 0,075 мг в/в;
- Rolapitant 70–200 мг per os.
2. В конце операционного вмешательства:
- Ramosetron 0,3 мг в/в;
- Dolasetron 12,5 мг в/в;
- Tropisetron 2 мг в/в;
- Ondansetron 4 мг в/в, 8 мг под язык;
- Granisetron 0,35–3 мг в/в;
- Droperidol 0,625–1,25 мг в/в.
3. До операционного вмешательства, в составе премедикации:
- Haloperidol 0,5–2 мг в/м в/в;
- Methylprednisolone 40 мг в/в;
- Perphenazine 5 мг в/в;
- Promethazine 6,25–12,5 мг в/в;
- Ephedrine 0,5 мг/кг в/м;
- Dimenhydrinate 1 мг/кг в/в;
- Scopolamine трансдермальный пластырь, за 2 часа до оперативного вмешательства.
Профилактические дозы препаратов для детей
- Dexamethasone 150 мкг/кг максимально 5 мг;
- Dimenhydrinate 0,5 мг/кг максимально 25 мг;
- Dolasetron 350 мкг/кг максимально 12,5 мг;
- Droperidol 10–15 мкг/кг максимально 1,25 мг;
- Granisetron 40 мкг/кг максимально 0,6 мг;
- Ondansetron 50–100 мкг/кг максимально 4 мг;
- Tropisetron 0,1 мг/кг максимально 2 мг.
Частые комбинации препаратов для профилактики ПОТиР
1. Взрослые:
- Droperidol + Dexamethasone;
- антагонист рецепторов 5-HT3 + Dexamethasone;
- антагонист рецепторов 5-HT3 + Droperidol;
- антагонист рецепторов 5-HT3 + Dexamethasone + Droperidol;
- Ondansetron + Casopitant.
2. Дети:
- Ondansetron 0,05 мг/кг +Dexamethasone 0,015 мг/кг;
- Ondansetron 0,1 мг/кг + Droperidol 0,015 мг/кг;
- Tropisetron 0,1 мг/кг + Dexamethasone 0,5 мг/кг.
Немедикаментозные методы профилактики
Имеются данные о том, что стимуляция различными методиками точки P6 (дистальная треть предплечья), и срединного нерва с помощью титанической стимуляции снижают частоту развития ПОТиР в раннем послеоперационном периоде. Данные методы рекомендуется применять до либо после индукции анестезии. Эффект стимуляции сопоставим с применением распространенных антиэметиков и не зависит от возраста и инвазивности методики.
Лечение развившихся ПОТиР
При развитии ПОТиР терапия должна проводиться антиэметиками из фармакологического класса, не использовавшегося при периоперационной профилактике.
Профилактика ПОТиР не проводилась:
- Низкие дозы антагонистов рецепторов 5-HT3 (ондансетрон 1,0 мг; гранисетрон 0,1 мг; трописетрон 0,5 мг);
- Альтернативой является применение дексаметазона 2–4 мг в/в, дроперидола 0,625 мг в/в или прометазина 6,25–12,5 мг в/в.
Профилактика ПОТиР проводилась:
- При развитии ПОТиР спустя > 6 часов после оперативного вмешательства возможно повторное введение короткодействующих препаратов: ондансетрон 4 мг для взрослых и 0,1 мг/кг для детей или дроперидол 1 мг для взрослых 10–15 мкг/кг для детей;
- Не рекомендуется повторное введение длительнодействующих препаратов: дексаметазона, ТДПС, апрепитанта, палоносетрона.
При неэффективности предыдущего этапа:
- Дименгидринат 1 мг/кг для взрослых и 0,5–1,0 мг/кг для детей;
- При отсутствии эффекта используются препараты других групп, не применявшиеся ранее.
При развитии ПОТиР необходимо исключить механические и лекарственные причины тошноты и/или рвоты: высокие дозы опиоидов, затекание крови и/или других жидкостей в гортань (часто после тонзилэктомии), кишечную непроходимость.
Источник:
Gan, Tong J.; Diemunsch, Pierre; Habib, Ashraf S.; Kovac, Anthony “Consensus Guidelines for the Management of Postoperative Nausea and Vomiting” Anesthesia & Analgesia: January 2014 – Volume 118 – Issue 1 – p 85–113
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
