Рвота при канцероматозе брюшины
Канцероматоз брюшины — опухолевое поражение листков слизистой оболочки, покрывающей органы и внутреннюю стенку живота. Преимущественно обусловлен разрастанием метастазов рака в брюшной полости, иногда возможно развитие первичного злокачественного процесса — мезотелиомы в самой брюшине.
Метастатическое поражение правильнее называть «карциноматоз», поскольку карцинома — синоним рака. Аналогично метастазы саркомы в брюшину именуют «саркоматоз».
Частое, но не обязательное проявление перитонеального канцероматоза, — выработка асцитической жидкости. С асцитом или без, но поражение брюшины злокачественным процессом всегда угрожает жизни больного и требует очень непростого лечения.
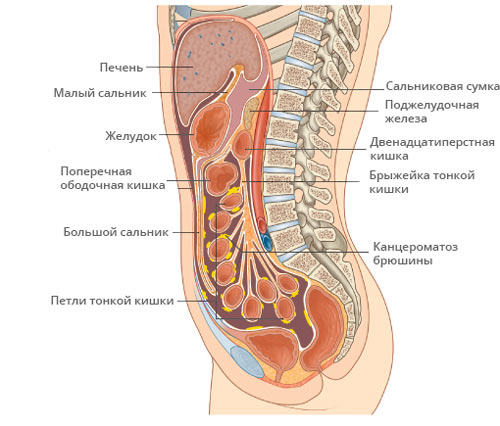
Причины канцероматоза брюшины
Не всякая оторвавшаяся от материнской раковой опухоли клетка способна стать метастазом, в кровеносном русле погибает львиная доля циркулирующих злокачественных клеток. Для обретения способности стать метастазом раковая клетка должна измениться внутренне — научиться вырабатывать вещества, позволяющие самостоятельно жить и внедриться в другом месте, подавляя нормальные клетки.
Оторвавшиеся от узла клетки мигрируют на большие расстояния, раздвигая нормальные клетки, имплантируются в брюшную слизистую, способны даже внедряться внутрь других клеток. После закрепления на местности, начинается размножение и образование целой клеточной колонии.
Кроме переноса метастатических клеток по крови и лимфе, распространение идёт и внутри полости живота — трансцеломически. Не совсем ясно почему злокачественные клетки задерживаются в брюшине, предполагается благотворное действие микроклимата. Большинство метастазов находят в местах с более спокойной обстановкой и слабой перистальтикой органов, или там, где активно всасывается внутрибрюшная жидкость.
Часто клетки «разбрасываются» во время операции и при лапароскопическом вмешательстве вероятность обсеменения вдвое ниже, чем при классической хирургии. Во время операции обязательно проводится профилактика раковой диссеминации путём неоднократной обработки специальными растворами, но самый эффективный способ очищения от диссеминатов — внутриполостная химиотерапия на фоне гипертермии (HIPEC).
При каких заболеваниях развивается
Перитонеальный канцероматоз диагностируют у каждого третьего пациента с новообразованием желудочно-кишечного тракта. Метастазы по брюшине характерны для карцином желудка и поджелудочной железы — поражается до 40% пациентов. При раке кишечника канцероматоз обнаруживают только у десятой части больных. Максимально высокий процент обусловлен злокачественными процессами яичников — на момент выявления болезни две из трёх пациенток уже имеют опухолевые узлы на брюшине.
Вероятность канцероматоза зависит от степени агрессивности раковых клеток и величины первичной опухоли, так при тотальном инфильтративном раке желудка его выявляют чаще, чем при локальном процессе, не разрушившем наружную серозную оболочку органа.
Тем не менее, ни при одном из злокачественных процессов любой локализации, будь то рак молочной железы или простаты, лёгкого или носоглотки, не исключается внутрибрюшинное метастазирование. Посмертно канцероматозные изменения выявляют у каждого третьего, погибшего от прогрессирования заболевания.
Для сарком такая локализация метастазов нетипична, саркоматоз брюшины констатируется едва ли у трёх из сотни больных. В редчайших случаях совершенно доброкачественные по гистологии муцинозные аденома аппендикса и цистаденома яичников тоже способны привести к обсеменению брюшины с выработкой гелеобразного секрета.
У одного из миллиона, и много чаще это будет женщина, выявляют муцинозную аденому аппендикса или муцинозную цистаденому яичников, в последующем часто приводящие к обсеменению брюшины. Распространение аденомуцинозных клеток в полости живота с выработкой гелеобразного секрета именуют уже «псевдомиксома», зачастую при в этой стадии заболевания не удаётся определить первоисточник опухоли.
Диагностика канцероматоза брюшины
Не представляет трудности выявление опухолевого поражения брюшины при асците, в отсутствии выработки патологического секрета диагностика опирается на визуализацию — УЗИ и КТ с контрастированием.
При УЗИ на внутреннем листке, прилежащем к мышцам брюшной стенки, в норме очень тонком и незаметном, можно увидеть напластования толщиной в несколько сантиметров, практически не прослеживаются только мелкие узелки.
КТ с контрастным усилением много информативнее УЗИ, способно выявить сантиметровые образования. Наиболее точный диагностический метод — лапароскопия. Это обследование обязательно при карциноме желудка, при раке яичников предпочтительна операция — диагностика и лечение одновременно.
При лапароскопии или пункции получают асцитическую жидкость для исследования и определения первоисточника злокачественного процесса. Из экссудата выделяют осадок, который изучают под микроскопом и проводят специфические реакции — ПЦР и ИГХ.
ПЭТ на этапе первичной диагностики не всегда информативна, поскольку далеко не все злокачественные клетки легкого, печени, почек способны накапливать изотопы.
Вне всяких сомнений, самый оптимальный метод диагностики — получение кусочка опухолевой ткани для исследования. Биопсия не целесообразна при известном источнике метастазов и после недавнего лечения первичного рака.
Стадии канцероматоза брюшной полости
Стадирование перитонеального канцероматоза нельзя назвать точным, все классификации приблизительны в определении объёма повреждений и не уточняют локализацию узлов. Зачастую, стадирование даёт общее представление о прогнозе эффективности лечебных мероприятий, нежели информирует о настоящем состоянии внутри полости живота.
Разработанная японскими специалистами градация опухолевого распространения по трём степеням, учитывает общий объём поражения, без числа и размеров очагов:
- P1 — ограниченное;
- P2 — разделённые нормальной тканью очаги;
- P3 — множество узлов.
Во время операции хирурги определяют индекс перитонеального канцероматоза (РСI), измеряя узелки в 13 регионах полости, общая сумма баллов влияет на тактику лечения, в первую очередь, на возможность удаления брюшины — перитонэктомию и целесообразность внутриполостной химиотерапии. При некоторых злокачественных процессах прибегают к сложным формулам расчёта РСI.
Наибольшее представление о размерах ракового повреждения даёт стадирование по степеням:
- 0 — в полости чисто,
- I — в одной анатомической зоне узелки до 5 мм,
- II — множественные узелки до 5 мм,
- III — локальное поражение 0.5–2 см,
- IV — 2-х сантиметровые узелки.
Течение канцероматоза определяется не столько размером метастатического узла, сколь клеточной потенцией к прогрессии и выработке асцитической жидкости, общей площадью опухолевой трансформации и клиническими проявлениями.
Симптомы канцероматоза брюшной полости
Перитонеальный канцероматоз небольшой протяжённости может не проявлять себя симптомами, особенно в отсутствии выработки асцитической жидкости. С другой стороны, жидкость может продуцироваться и при отсутствии видимых метастазов. Как правило, симптоматика неспецифична, и в разном наборе могут отмечаться:
- меняющие локализацию болезненные ощущения, а чаще — непонятный дискомфорт в полости живота;
- нарастающая слабость до утраты работоспособности;
- потеря веса при стабильном диетическом режиме;
- прогрессирующее снижение аппетита;
- функциональные нарушения со стороны органов ЖКТ.
Дальнейшее нарастание раковых повреждений сопровождается опухолевой интоксикацией, сдавление желудка опухолевыми узлами осложняется тошнотой и рвотой, кишечника — запорами и поносами с усугублением частичной непроходимости. Распад крупных узлов может вызывать боли и повышение температуры.
Асцит нарушает процесс дыхания и вызывает сердечную недостаточность с постоянными отёками, а частая эвакуация патологической жидкости приводит к белковой недостаточности.
Как лечат канцероматоз брюшины
Ни один из современных методов лечения канцероматоза не гарантирует радикального удаления опухоли, не способен излечить, но может улучшить состояние и существенно продлить жизнь.
Хирургическое лечение канцероматоза технически сложное для оперирующей бригады и трудно переносимое пациентом, поскольку предполагает удаление первичного рака, увеличенных лимфатических узлов, сальниковых сумок и всех видимых опухолевых образований вместе с брюшиной.
Перитонэктомия — многоэтапное вмешательство, включающее удаление нескольких органов и отделов брюшной полости. В результате операции пациент может остаться без селезёнки, желчного пузыря, части кишечника, матки с придатками.
Стандарт терапии канцероматоза — химиотерапия системная и локальная — внутрибрюшинная после удаления асцита или через лапаропорт, установленный во время операции.
Эффективность лекарственной терапии невысокая, за исключением случаев первичного рака яичников. Таргетные и иммуно-онкологические препараты только изучаются в клинических испытаниях.
Какие методики терапии дают лучший результат
Наиболее высокий эффект демонстрирует комбинация трёх методов лечения рака:
- Операция с максимально возможным удалением злокачественных новообразований — циторедукция.
- Локальная внутрибрюшинная гипертермия.
- Внутриполостное введение химиопрепаратов.
Использование во время хирургического вмешательства интраперитонеальной гипертермической химиотерапии (ИГХТ или HIPEC) позволяет максимально долго поддерживать очень высокую концентрацию цитостатика непосредственно в зоне поражения и усилить лекарственное воздействие нагреванием тканей. При весьма скромных исторических результатах хирургического вмешательства устойчивой к цитостатикам псевдомиксомы только HIPEC открывает пациентам перспективу на долгую жизнь.
Технология ИГХТ такова: в течение полутора часов внутрь брюшной полости под давлением подаётся нагретый химиопрепарат в дозе, существенно превышающей максимально разрешённую для внутривенного введения. За счёт локального использования изменяется спектр токсических реакций, исключается опасное для жизни повреждение кроветворения, но возможна боль в животе и временное нарушение функционирования органов ЖКТ.
Интраоперационная фотодинамическая терапия (ФДТ), когда на выявленные с помощью фотосенсибилизатора очаги опухоли воздействуют лазером, уступает HIPEC по результативности, поскольку лазером невозможно проникнуть во все «закоулки» брюшной полости. Тем не менее, целесообразно использование фотодинамической терапии при крупных и немногочисленных раковых узлах.
Прогноз при канцероматозном поражении
На течение процесса влияет объём поражения на момент начала терапии, степень злокачественности опухоли, в свою очередь определяющая чувствительность к химиотерапии. Основополагающее влияние оказывает талант и опыт хирурга, и несомненно, правильность выбора лечебной тактики.
Однозначно революционные результаты в клинических испытаниях показала только HIPEC. После интраоперационной гипертермической ХТ пятилетняя выживаемость при канцероматозе рака желудка выросла максимально до 20%, все прочие методы исключали столь долгое дожитие. При раке толстой кишки с метастазами по брюшине каждый третий пациент прожил более 5 лет, при карциноме слепой кишки и аппендикса — шестеро из десяти вступили во вторую пятилетку жизни.
Список литературы
- Давыдов М.И., Тер-Ованесов М.Д., Буйденок Ю.В. с соавторами/ Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз? // Вестник РОНЦ им. Н. Н. Блохина РАМН; 2010 Т. 21; № 1
- Степанов И.В., Падеров Ю.М., Афанасьев С.Г./ Перитонеальный канцероматоз// Сибирский онкологический журнал; 2014; № 5
- Akiyama H., Yamaoka H., Tanaka K., et al./ Continuous hyperthermic peritoneal perfusion for peritoneal dissemination of gastric cancer // Hepatogastroenterology; 1998.
- Bozzetti F., Bonfanti G., Morabito A., et al/ A multifactorial approach for the prognosis of patients with carcinoma of the stomach after curative resection // Surg. Gynecol. Obstet.; 1986.
- Cotte E., Passot G., Gilly F.N., Glehen O. /Selection of patients and staging of peritoneal surface malignancies // World J. Gastrointest. Oncol.; 2010; Vol. 2.
- Chua T.C., Moran B.J., Sugarbaker P.H., et al. /Early- and longterm outcome data of patients with pseudomyxoma peritonei from appendiceal origin treated by a strategy of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy// J. Clin Oncol 2012.
- Deraco M., Santoro N., Carraro O., Inglese M.G., et al./ Peritoneal carcinomatosis: feature of dissemination. A review // Tumori; 1999.
- Lansom J., Alzahrani N., Liauw W., Morris D.L. /Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy for Pseudomyxoma Peritonei and Appendix Tumours // Indian J Surg Oncol. 2016 Jun.
- Sugarbaker P.H./ Overview of peritoneal carcinomatosis // Cancerologia; 2008.
Источник
Метастазирование — характерный признак ракового заболевания на поздней стадии. Клетки опухоли отрываются и разносятся за ее пределы кровью и лимфой. Одни из них погибают по пути, а другие закрепляются на новом месте и формируют вторичные очаги — метастазы.

Наш эксперт в этой сфере:
Заместитель главного врача по лечебной работе,
врач-онколог, хирург, к.м.н.
Позвонить врачу
В организме есть области, в которых метастазы образуются чаще всего. Одно из них — брюшная полость. Это объясняется рядом факторов — наличием густой сети кровеносных и лимфатических сосудов, особым микроклиматом, близостью органов пищеварительной и репродуктивной систем.
Изнутри брюшную полость выстилает тонкая серозная пленка — брюшина. Закрепившись в брюшине, раковые клетки начинают быстро делиться и формируют узелки. Сначала это небольшие образования размерами с зернышко, но процесс их роста происходит очень быстро. Количество узелков растет, они увеличиваются и сливаются в большие опухоли. Этот процесс называется канцероматозом брюшины.
Это не самостоятельное заболевание, а следствие распространения раковых клеток за пределы первичного очага. Чаще всего поражение брюшины метастазами происходит при раке органов ЖКТ, а также половых органов у женщин. При раке желудка и поджелудочной железы канцероматоз брюшины возникает в 40% случаев, при раке толстого кишечника — в 15% случаев, при раке яичников — в 60% случаев. Нередко он развивается при раке матки, молочной железы, печени, тонкого кишечника.
Метастазирование — не единственная причина канцероматоза брюшины. Осеменение брюшной полости раковыми клетками возможно при хирургическом удалении опухоли (лапароскопические операции значительно снижают этот риск).
Еще одна возможная причина появления раковых клеток на брюшине — прорастание опухоли в брюшную полость за пределы органа (например, карциномы желудка).
Лечение канцероматоза брюшины невозможно проводить без удаления первичной опухоли и всех ее метастазов. Ведь наряду с брюшной полостью она поражает и другие органы, а также лимфатические узлы.

Канцероматоз возникает только на поздней стадии ракового заболевания, а это значит, что его лечение представляет крайне сложную задачу, зачастую невыполнимую. До недавнего времени прогноз для большинства пациентов был негативным. Продолжительность их жизни составляла до двух, максимум до шести месяцев.
И только появление инновационной технологии гипертермической химиотерапии (HIPEC) помогло совершить революционный прорыв и увеличить продолжительность жизни при канцероматозе брюшины с нескольких месяцев до нескольких лет.
Так пятилетняя выживаемость пациентов с метастазами в брюшной полости на фоне рака толстой кишки после применения HIPEC составляет более 30%.
Эта прогрессивная методика сегодня применяется в клинике «Медицина 24/7» и показывает хорошие результаты практически во всех случаях, когда она показана. А показана она, к сожалению, далеко не всем пациентам с канцероматозом брюшины.
В остальных случаях приходится ограничиваться традиционными методами. Тем не менее, мы стараемся помочь всем своим пациентам, даже на самой поздней стадии процесса, методами паллиативной медицины, обезболивания и другой симптоматической терапии.
Стадии и симптомы
Поскольку канцероматоз брюшины — не самостоятельное заболевание, а вторичный процесс, его стадия оценивается не столько по величие отдельных очагов, а по увеличению их количества и площади распространения.
На первой стадии это один или несколько небольших узелков (до 5 мм),находящихся в ограниченном сегменте брюшной полости. На второй стадии количество метастазов увеличивается, но их разделяют участки здоровой ткани. На третьей и четвертой стадиях отдельные очаги растут (до 2 см),сливаются и покрывают значительную поверхность брюшины.
Общая площадь брюшины составляет около двух квадратных метров. В норме это тонкая пленка, но с развитием канцероматоза ее толщина увеличивается, узлы достигают больших размеров и давят на кишечник, желудок. Это проявляется такими симптомами как тошнота, рвота, длительные запоры, которые сменяются диареей. В животе ощущается дискомфорт, возникают приступообразные или постоянные ноющие боли.
Характерный признак канцероматоза брюшины — асцит. В брюшной полости скапливается жидкость. Из-за этого живот раздувается, что становится еще больше заметно на фоне общего похудения, снижения веса из-за раковой интоксикации. Скопление жидкости мешает нормальному дыханию, провоцирует развитие сердечной недостаточности.
Сопутствующие симптомы канцероматоза зависят от локализации первичной опухоли и распространения ее метастазов за пределами брюшной полости. Общие признаки поздней стадии онкологического заболевания — слабость, потеря аппетита, упадок сил, кахексия, головные и мышечные боли, повышенная температура, потливость.
Терпеть боль опасно для жизни!
Берегите себя, запишитесь на консультацию сегодня
Диагностика
Асцит — обычный, но не обязательный признак канцероматоза брюшины. Поскольку процесс развивается быстро, он часто приводит к тяжелым состояниям, требующим экстренной госпитализации. В этих случаях диагностика не вызывает затруднений.
Исследования проводятся, чтобы лучшим образом определить тактику лечения. Это, в первую очередь, УЗИ органов брюшной полости и малого таза.
Ультразвуковое исследование помогает изучить состояние лимфатических узлов, внутренних органов, оценить количество, величину метастазов, определить их локализацию и площадь распространения.
Более подробную информацию дают компьютерная томография и МРТ. С их помощью проводится детальное и подробное исследование метастатических образований, их структуры, характера поражения тканей. КТ дает возможность обнаружить самые мелкие очаги канцероматоза.
КТ с контрастированием применяется, чтобы исследовать лимфатические узлы, отдаленные метастазы.
Максимум информации дает исследование под микроскопом асцитической жидкости или фрагмента ткани брюшины из очагов канцероматоза.
Забор ткани для гистологического исследования делается посредством лапароскопической биопсии, а забор жидкости для цитологического исследования — посредством пункции.
Мы вам перезвоним
Оставьте свой номер телефона
Лечение
Поскольку канцероматоз брюшины — это вторичный процесс, его лечение не даст результатов, если не удалить первичную опухоль и все ее метастазы. Речь идет о частичной или полной резекции пораженных органов — селезенки, желчного пузыря, матки, яичников, желудка, толстого кишечника, а также лимфатических узлов. Только в этом случае оно может быть успешным.
Одновременно нужно удалить все метастатические очаги в брюшной полости. Такая операция может быть проведена открытым или лапароскопическим методом. В обоих случаях решающее значение имеет квалификация и мастерство хирурга, чтобы найти и удалить все узловые образования.
Системная химиотерапия может проводиться как до, так и после операции. При невозможности или нецелесообразности хирургического вмешательства она может быть проведена в паллиативных целях.
В ряде случаев именно HIPEC дает положительные результаты, когда обычное хирургическое и химиотерапевтическое лечение дать таких результатов не может.
Сначала проводится циторедуктивная операция — хирург удаляет все очаги канцероматоза диаметром более 1–2 мм. Далее брюшная полость наполняется подогретым до 42–43 градусов концентрированным раствором химиопрепаратов и промывается им в течение 1,5–2 часов. За это время уничтожаются все раковые клетки, которые погибают как от химиотерапии, так и от воздействия высокой температуры. После этого раствор сливается.
Эффективность этой процедуры объясняется, в первую очередь, высокой концентрацией химиопрепаратов, невозможной при внутривенном введении. При этом она оказывает меньше побочных эффектов, так как раствор действует локально, без проникновения в кровь, и не оказывает влияния на процесс кроветворения.
Подогрев химиопрепарата повышает его эффективность и способность проникать вглубь узлов.
HIPEC — это действительно эффективное, мощное и радикальное, но не универсальное средство лечения канцероматоза. Она показана не при всех видах рака. При наличии множественных, отдаленных метастазов за пределами брюшной полости она не проводится, поскольку не дает результатов.
Наши врачи вам помогут
Оставьте свой номер телефона
Обработка горячим раствором химиопрепаратов выполняется только после иссечения основного очага опухоли, ее метастазов, лимфатических узлов. В комплексе с циторедуктивной операцией на брюшине это занимает несколько часов, за которыми следует два часа промывания. Это серьезное испытание для организма, истощенного болезнью.
Еще один метод лечения канцероматоза — фотодинамическая терапия. Метастатические узлы уничтожаются с помощью лазера. Для этого их клетки предварительно насыщаются поглощающими веществами — фотосенсибилизаторами. После этого их облучают светом с определенной длиной волны, запуская фотохимическую реакцию, которая убивает раковые клетки. Этот метод дает хорошие результаты в случаях единичных крупных узлов канцероматоза.
Материал подготовлен заместителем главного врача по лечебной работе клиники «Медицина 24/7», кандидатом медицинских наук Сергеевым Петром Сергеевичем.
Источник
